纯镁的腐蚀特性
纯镁的腐蚀特性
像大多数金属和合金一样,镁也依靠自然的表面膜来控制其腐蚀。但是,该膜的性质尚未完全理解。好的钝化膜是那些限制阳离子向外流,抵抗有害阴离子或氧化剂向内流,并在发生局部击穿时迅速自我修复的膜。表面膜的结构和组成在很大程度上取决于环境和冶金因素,例如电解质种类和金属中的杂质,决定了钝化膜的保护能力。
2.1。环境影响没有一种材料在所有环境中都显示出高耐腐蚀性。材料的高耐腐蚀性总是指某些特定的环境。镁有其自己的首选服务环境。但是,与钢和铝合金等其他材料相比,适用于镁和镁合金的介质较少。例如,镁和镁合金通常在碱性溶液中是稳定的,但在中性和酸性介质中,它们的溶解速率很高[ 3 ]。这与通常在中性介质中稳定但在碱性和酸性溶液中均不稳定的铝合金完全不同。
2.1.1。水溶液中的一般腐蚀几乎没有例外,除非存在水,否则在室温下纯镁不会受到明显腐蚀[ 4 ]。镁在水或水性环境中的溶解通常通过与水发生电化学反应而进行,以产生氢氧化镁和氢气。尽管氧气的存在是大气腐蚀的重要因素,但这种机制对氧气浓度相对不敏感[ 5 ]。反应1描述了可能的总体反应:
镁+2H2Ø=中号G(O H)2+H2镁+2H2Ø=中号G(ØH)2+H2E1该净反应可以表示为以下部分反应的总和:
阳极的ř Ë一个ç吨我ø Ñ :中号 G→中号G2 ++2 e阳极的[RË一种CŤ一世Øñ: 中号G→中号G2++2ËE2
阴极的ř Ë一个ç吨我ø Ñ :2 H2Ø+2 e→H2+2 ØH-阴极的[RË一种CŤ一世Øñ: 2H2Ø+2Ë→H2+2ØH--E3
产品展示FÔ ř米一吨我ø Ñ :中号 G2 ++2 ØH-→ MG(O H)2产品展示FØ[R米一种Ť一世Øñ: 中号G2++2ØH--→中号G(ØH)2E4
氢离子的还原过程和阴极的氢过电压在Mg的腐蚀中起重要作用。低过电压的阴极有助于氢的释放,从而导致大量的腐蚀速率[ 6 ]。
图1显示了Mg-H 2 O系统中Mg的腐蚀域。水稳定性区域位于线a和线b之间。在a线以下的电势下,放出了氢。在b线上方,放出了氧气。数字标识反应5、6和7中显示的分离不同相的反应。反应5和6的水平和垂直平行线给出的Mg 2+浓度以mol l -1为10的幂。如图1所示,带圆圈的线分隔了腐蚀(溶解的阳离子,例如Mg 2+),抗扰性(未反应的金属,Mg)和钝化(腐蚀产物,Mg(OH)2)[ 5 ]的区域。从从图1中可以看出,取决于电势和pH值,预期将形成稳定的膜。在中性和碱性环境中,氢氧化镁产品可以形成一层表面膜,该膜对纯镁或其普通合金具有显着的腐蚀保护作用,尽管其效果不如在铝上形成的氧化层有效。随着腐蚀的进行,由于形成Mg(OH)2,其平衡pH约为11 ,金属表面的局部pH值会增加。因此,该膜提供的保护很大程度上取决于暴露条件。据报道,当在25°C下暴露于2种普通KOH溶液中时,高纯度镁的腐蚀速率每年为10 -2 -10 -3 mils(mpy)[3 ]。
大号我ñ ë一:2H++ 2 e →H2 大号我ñ ëb : 4 ØH-− 4 e →Ø2+H2Ø 大号一世ñË一种:2H++ 2Ë→H2 大号一世ñËb: 4ØH---- 4Ë→Ø2+H2Ø
1.镁 + 2H2Ø=中号G(O H)2+H2 1。 镁+2H2Ø=中号G(ØH)2+H2 E5
2. M G2 ++H2Ø=中号GØ+2H+2。 中号G2++H2Ø=中号GØ+2H+E6
3 。中号 G=中号G2 ++2 e3。 中号G=中号G2++2ËE7 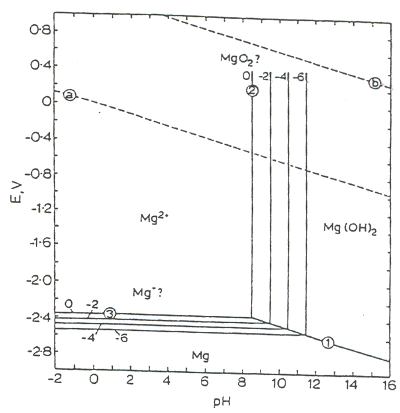
图1。
镁-水系统在25°C时的电化学势-pH平衡图[5]。
镁在纯水中的腐蚀性能在很大程度上取决于温度。在升高的温度下,随着温度的升高,水中的耐腐蚀性降低,在100°C以上时腐蚀变得尤为严重[ 3 ]。
镁容易被大多数酸溶解。即使在强酸和弱酸的稀溶液中,镁也会迅速溶解。有一些例外,例如铬酸和氢氟酸[ 6 ]。镁在铬酸中的溶解非常缓慢,是由于镁在该酸中变得被动。形成的MgF 2不溶性表面膜可防止进一步侵蚀,这是镁对氢氟酸具有抗性的原因[ 66 ]。
镁上天然氢氧化物膜的强碱度意味着该化合物几乎不会向质子中释放质子;因此,该膜提供了即使在强烈的热碱溶液,将容易地攻击铝或锌合金的[极好的保护6,7 ]。镁的耐碱侵蚀性与金属的轻质性相结合,使之成为多年来水泥修整工具的首选材料[ 7 ]。
2.1.2。含有特定离子的溶液中的腐蚀盐溶液在其腐蚀性变化以镁[ 7 - 9 ]:碱金属或碱土金属(铬酸盐,氟化物,磷酸盐,硅酸盐,钒酸盐,或硝酸盐)引起很少或没有腐蚀。特别是铬酸盐,氟化物,磷酸盐和硅酸盐,由于它们能够形成某种程度的保护膜,因此经常用于化学处理和阳极氧化镁表面。氯化物,溴化物,碘化物和硫酸盐通常会加速水溶液中镁的腐蚀。几乎所有的重金属盐都可能引起腐蚀,因为镁通常会因其高化学活性而从溶液中置换出重金属,磷酸铁溶液除外。
宋等 [ 10 ]等人研究了纯镁在1N NaCl和Na 2 SO 4溶液中的电化学腐蚀。已发现部分保护性表面膜在镁在NaCl和Na 2 SO 4溶液中的电化学溶解过程中起着重要作用。氯的存在下-进行的表面薄膜多种活性或增加的天然形成的保护膜的破裂区,并根据反应8和9也加速了电化学反应速率从镁一价离子,从而增加了腐蚀速率。SO 4 -具有比氯的影响较小- 。
镁↔中号G++Ë镁↔中号G++ËE8
镁++H2Ø →中号G2 ++ØH-+(½ )H2 镁++H2Ø→中号G2++ØH--+(½)H2 E9
在Makar和Kruger的综述中[ 17 ],发现浸在3%氯化钠中的镁上的膜由Mg(OH)2,MgCl 2 •6H 2 O和Mg 3(OH)5 Cl•4H 2组成。 O,其通过红外光谱和X射线衍射鉴定。另外,镁上的稳定化膜还包含MgH 2。
形成保护膜的氧化性阴离子,尤其是铬酸根,重铬酸根和磷酸根,可以大大提高镁在水或盐水溶液中的耐蚀性[ 6 ]。
2.1.3。有机化合物引起的腐蚀评论中[ 7],发现有机化合物,除少数例外,对镁及其合金几乎没有影响。在参考文献7和9中已经指出,镁可用于与芳族和脂族烃,酮,酯,醚,二醇,酚,胺,醛,油和高级醇接触。乙醇会引起轻微的侵蚀,但是无水甲醇会引起严重的侵蚀,除非引入大量的水分。大多数干燥的氯化碳氢化合物在沸点以下对镁几乎没有影响。在水的存在下,特别是在高温下,氯化碳氢化合物可能水解形成盐酸,从而导致镁的腐蚀。干燥的氟化碳氢化合物(例如制冷剂)在室温下不会侵蚀镁。但是,如果有水,水解可能引起腐蚀。在诸如果汁和碳酸饮料之类的酸性食品中,镁的侵蚀缓慢但可测量。牛奶会引起发作,特别是在变酸时7,9 ]。
镁发动机缸体的目标是减轻汽车的重量,并且腐蚀是发动机缸体的冷却系统中的主要问题。Song等人[ 11 ]报道说,传统冷却剂中的某些抑制剂主要成分为30-70%(体积)的乙二醇和钼酸盐,磷酸盐,硼酸盐,亚硝酸盐,甲苯基三唑,苯甲酸盐和硅酸盐抑制剂,不能提供足够的腐蚀。对镁和镁合金的保护。因此,一些公司正在开发含有镁和镁合金新型抑制剂的冷却剂。宋等。[ 11]研究了纯镁在含有各种离子的乙二醇中的腐蚀行为。发现镁在乙二醇水溶液中的腐蚀速率取决于溶液的浓度。在室温下,稀乙二醇溶液比浓溶液更具腐蚀性。被个别污染物NaCl,NaHCO 3和Na 2 SO 4污染的乙二醇溶液对纯镁更具腐蚀性。NaCl是最有害的污染物,而在NaCl污染的乙二醇溶液中,少量的NaHCO 3或Na 2 SO 4具有一定的抑制作用[ 11]。乙二醇中的氟化物可以有效地减少镁的腐蚀,这是因为在镁表面形成了保护性的含氟保护膜。已经观察到[ 11 ],少量污染物(Na 2 SO 4,NaHCO 3)的添加降低了含氯化物的乙二醇溶液中镁的腐蚀。
2.1.4。空气中的腐蚀湿度在镁的腐蚀中起主要作用[ 12 ]。镁的腐蚀随着相对湿度的增加而增加。在10%的湿度下,纯镁在18个月后没有显示出表面腐蚀的迹象。但是,在30%的湿度下,可见的少量可见表面氧化物混浊和轻微的腐蚀是明显的,而在80%的湿度下,约30%的表面显然存在非晶相,并且该表面表现出相当大的腐蚀。仅当相对湿度为93%或以上时,才会形成结晶氢氧化镁。在参考文献5中,提出了一种关于有序薄膜提供更好保护的理论解释,即没有晶界的薄膜比结晶薄膜更能抵抗离子的运动。
此外,在大气中存在300ppm的CO 2和通常1ppm的SO 2在表面膜的形成中也起重要作用。在大气中,已经报道了CO 2在潮湿空气中的抑制作用[ 4 ]。最初,环境水平的二氧化碳会增强腐蚀作用,但是,在CO 2存在的情况下,腐蚀速率会随着暴露时间的增加而降低。建议从腐蚀的初始增强起因于碳酸的质子分解,从而导致表面电解质的pH降低,如反应10和11所示。表面电解质中pH的降低起到了提高电解质溶解速度的作用。气膜。
一氧化碳2(一个q)+H2Ø ↔ ^ hCØ-3+H+一氧化碳2(一种q)+H2Ø↔HCØ--3+H+E10
HCO-3↔ ç Ø32 -+H+HCO--3↔ CØ32--+H+E11
在阴极反应中产生或从薄膜中溶解的氢氧根离子可与碳酸形成碳酸根。在CO 2的存在下,形成碳酸羟基镁镁(反应12)。
2 MG2 ++CØ32 -+2 ØH-+ 3H2Ø=中号G2(O H)2CØ3。3H2Ø 2中号G2++CØ32--+2ØH--+3H2Ø=中号G2(ØH)2CØ3。3H2Ø E12碳酸羟基镁也可以通过固体氢氧化镁与CO 2和水反应形成。比氢氧化镁膜厚的碳酸盐膜的存在会干扰阳极和阴极反应,从而降低腐蚀速率。此外,CO 2的原分解抵消了表面上的pH梯度的发展,阻碍了宏观腐蚀池的发展,从而导致了点蚀的抑制。因此,高纯度镁和镁合金具有极强的抗腐蚀能力,并且在大气中的性能优于铁。
在城市/工业场所,表面膜中MgSO 4 -6H 2 O和MgSO 3 -6H 2 O可能占主导。MgSO 4 -6H 2 O和MgSO 3 -6H 2 O的溶解度高,容易洗掉,重新暴露了表面。因此,纯镁在工业大气压[耐腐蚀性差3,9 ]。
2.2。冶金效果如果存在大量杂质或与其他金属接触,镁将变得易于加速腐蚀。由于杂质上缺乏自然的表面膜,较高的正电势使杂质成为氢放电的有效阴极,从而显着提高了腐蚀速率的微电流[ 13 ]。因此,即使纯镁中含有少量氢过电压较低的金属(如Fe,Ni,Co或Cu)中的少量杂质,也会大大降低其耐腐蚀性。具有较高的氢过电压,如铅,锌,镉和,并且还强电负性的金属,如锰和铝的金属,在这方面[更少危险6 ]。图2图1显示了杂质和合金元素对室温下3%NaCl溶液中镁腐蚀的影响。Fe,Cu,Ni可以提高腐蚀速率,而Cd,Pb,Sn和Al可以大大降低纯镁的耐腐蚀性。各种元素对镁合金腐蚀的影响将在第3.2节中详细讨论。
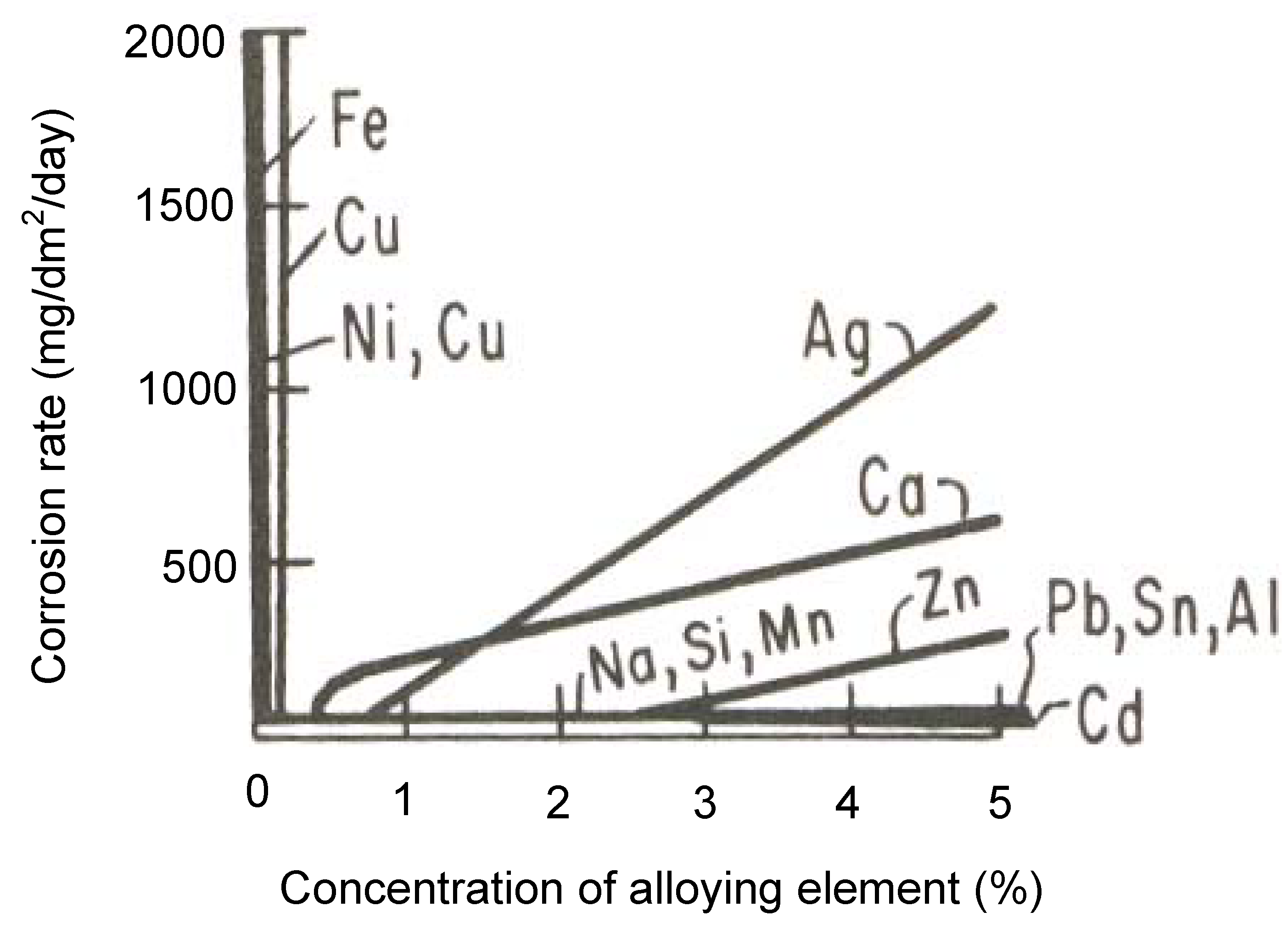 图2。
图2。在室温下,杂质和合金元素对3%NaCl溶液中镁腐蚀的影响(所有合金都是由镁和给定元素形成的)[6]。
上一篇:镁合金的腐蚀与表面处理 下一篇:镁合金的腐蚀特性
文章来源:@青蝠科技 作者:青蝠科技

- CNC精密加工
- 精密压铸
2022-08-06 14:12:15
什么是不锈钢?
不锈钢是不锈钢和耐酸钢的简称。...
2022-08-06 14:07:09
什么是铝合金1060?
铝1060是在纯铝中加入少量铜制成...
2022-08-06 14:00:07
什么是铝合金6063?
6063铝材广泛用于建筑铝门窗、幕...
2022-08-04 11:56:08
什么是铝合金7075?
7075铝合金是一种冷处理锻造合金...
2022-08-04 11:53:26
什么是铝合金2024?
2024铝为Al-Cu-Mg系铝合金,2024铝...
2022-08-04 11:49:59
什么是铝合金5052?
5052铝合金属于Al-Mg系合金,应用...
2022-08-04 11:41:03
什么是铝合金6061?
6061铝是一种热强化合金,具有良好...
2022-07-25 11:54:22
镁压铸的主要优点
如果情况需要,镁比其他金属具有许...